Qu’est-ce que les CAR-T cells ?
Le traitement par CAR-T cells (Chimeric Antigenic Receptor – T) ou cellules CAR-T est une thérapie cellulaire génétiquement modifiée (appelée également thérapie génique) qui vise à combattre le cancer en s’appuyant sur le propre système immunitaire du patient. Cette immunothérapie repose sur les lymphocytes T, des globules blancs dont le rôle est d’identifier et détruire toute cellule anormale ou infectée par des organismes étrangers (cellules cancéreuses, bactéries, virus).
Prise en charge par CAR-T cells
Les étapes du traitement :
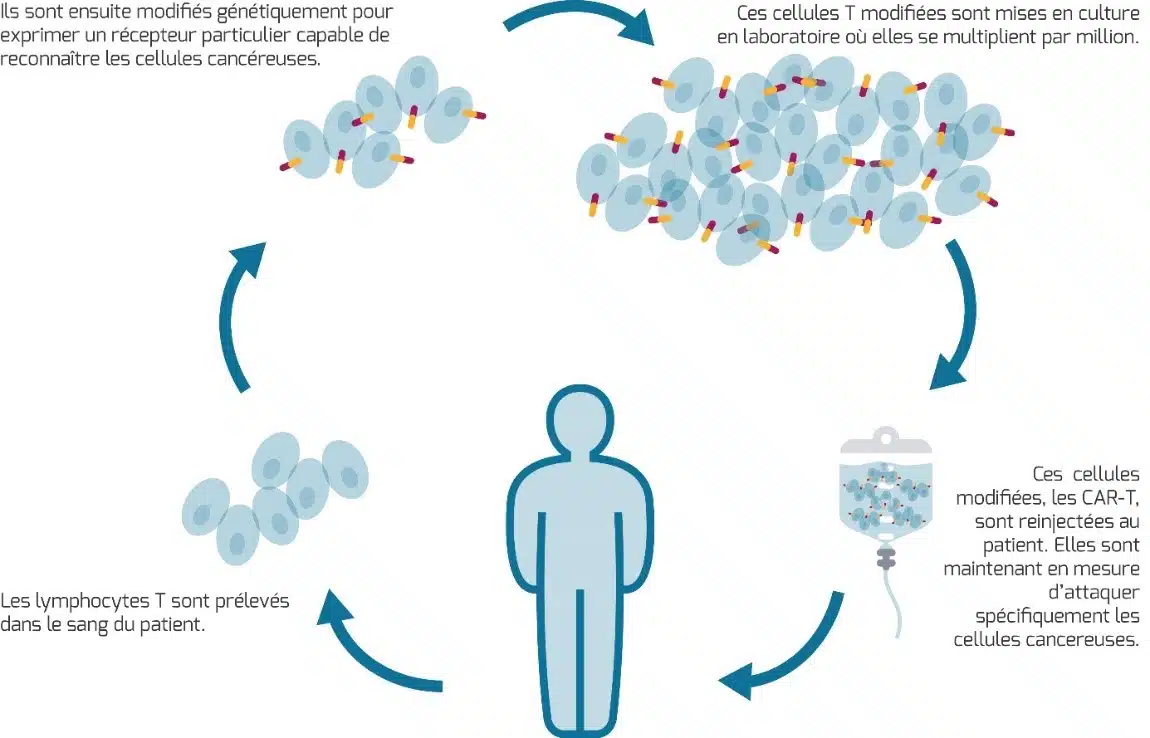
La production des CAR-T cells commence par le prélèvement des lymphocytes T du patient qui sont ensuite modifiés génétiquement afin qu’ils puissent reconnaître les cellules cancéreuses. Pour cela, ils sont dans un premier temps collectés par leucaphérèse, un prélèvement sanguin ciblant les globules blancs.
Après contrôle de leur qualité, ils sont modifiés génétiquement en laboratoire pour exprimer des récepteurs spécifiques à leur surface. On parle de récepteur antigénique chimérique (chimeric antigen receptor), CAR en anglais. Ces récepteurs permettront aux cellules modifiées, alors appelées CAR-T, de repérer des antigènes présents sur les cellules tumorales.
Une fois créées, les CAR-T cells sont multipliées dans l’optique d’être administrées au patient.
Avant l’injection, le patient reçoit une chimiothérapie lymphodéplétive dans le but d’affaiblir son système de défense immunitaire. Ainsi, en éliminant une partie des lymphocytes naturels, la multiplication des CAR-T cells sera favorisée et le risque de rejet sera limité. Une fois dans l’organisme, les CAR-T cells vont donc reconnaître et cibler les cellules tumorales de manière spécifique grâce au récepteur CAR, puis s’activer contre elles et les éliminer.
> En savoir plus sur le traitement – Immunothérapie : mode d’action | INCa
Recommandations nationales
Les avancées dans ce domaine soulèvent de nombreuses questions d’ordre éthique, pratique et juridique.
La législation française limite l’utilisation des CAR-T cells autologues à certains établissements de santé. Le traitement doit se faire dans un centre qualifié, autorisé à prélever les lymphocytes T et à administrer les cellules CAR-T
> Accéder à l’arrêté du 28 juin 2024 (mise à jour régulière sur le site Légifrance)
> Accéder aux centres qualifiés CAR-T
En 2019, la HAS a annoncé qu’elle réévaluerait les CAR-T cells afin de vérifier leur efficacité, tolérance ainsi que leur impact sur la qualité de vie à moyen et à long terme. Pour cela, elle a demandé à ce que des données complémentaires lui soient fournies annuellement. Ces données en vie réelle alimentent un registre commun aux différents CAR-T cells, le registre DESCART.
> Consulter le communiqué de presse de la HAS
La Société francophone de greffe de moelle et de thérapie cellulaire (SFGM-TC) travaille à :
- l’élaboration de procédures thérapeutiques partagées et harmonisées pour améliorer la sécurité et la qualité des soins des patients traités par CAR-T cells
- l’organisation d’ateliers d’harmonisation des pratiques , conduisant à des recommandations qui ont donné lieu à publications
Ces recommandations sont adaptées dans chaque centre en fonction de leurs moyens matériels et des ressources humaines.
> Accéder aux ateliers d’harmonisation des traitements par cellules CAR-T
Harmonisation des pratiques au niveau régional
Un groupe de travail régional a réalisé des fiches de consensus lymphomes destinées à faciliter la liaison entre les centres où sont administrés les CAR-T cells et les centres périphériques qui adressent les patients.
> En savoir plus sur le groupe de travail